- Indice:
- Introduzione
- Quanti tipi di vaccino anti Papillomavirus esistono attualmente?
- Come funziona il vaccino? Può provocare il rischio di contrarre malattie da HPV?
- La struttura del Papillomavirus umano
- Come si ottengono le proteine L1 del vaccino?
- Come va somministrato il vaccino?
- Quali sono le principali controindicazioni?
- Quali sono i principali effetti collaterali?
- Il vaccino è anche terapeutico?
- La protezione tramite vaccino è verso tutti i tipi di HPV che causano le patologie?
- E' vero che il vaccino anti HPV è in grado di offrire una "protezione crociata"?
- Quanto dura la protezione tramite vaccino? Esistono dei dati d'efficacia a lungo termine e come si valutano?
- Sarà necessario fare un richiamo?
- Per valutare l'efficacia di questa vaccinazione non sarebbe necessario fare il dosaggio degli anticorpi come si fa per altre vaccinazioni?
- È vero che si sono verificati casi gravi di reazioni avverse legate a questa vaccinazione?
- Approfondimenti specialistici
Introduzione
Nella donna, le infezioni da Papillomavirus, considerate su scala globale, sono responsabili di più del 50% dei carcinomi correlati ad infezioni, negli uomini ne causano meno del 5% (zur Hausen 2009).
Alcuni ceppi di HPV sono di maggiore interesse per la patologia umana, in quanto sono responsabili dei condilomi e di diverse forme tumorali. Nella donna, il tipo 6 e 11, a basso rischio oncogeno, causano il 90% delle verruche genitali o condilomi (Zur Hausen, 2002, 2009). I tipi di HPV, come l’HPV16 e L’HPV 18, ad alto rischio oncogeno, sono associati a più del 70% dei casi di cancro cervicale (Muñoz et Al, 2006; Smith et Al, 2007).
Il cancro del collo dell’utero rappresenta la seconda causa di morte per tumore in Europa tra le giovani donne tra i 15 e i 44 anni, dopo il tumore al seno. In Italia i casi diagnosticati ogni anno sono 3.500 con una percentuale di decessi di circa un terzo (più di 1000 donne).
A questi dati, che rappresentano ancora oggi un vero e proprio “bollettino di guerra”, si aggiungono quelli legati alle altre patologie da Papillomavirus che, in molti casi, non sono altro che lo stadio preliminare al tumore: 14.700 lesioni precancerose di alto grado al collo dell’utero e 47 mila di basso grado.
Gli HPV sono stati riconosciuti come agenti causali anche del cancro anale, vulvare, vaginale, nonché della testa e del collo, seppur in minor misura. Di questi virus sessualmente trasmessi possono essere contratti più tipi contemporaneamente (Zur Hausen, 2002, 2009).
Va poi considerato il notevole peso per la salute fisica e psicosessuale di altri 125 mila casi di condilomi genitali, che comportano elevati costi quantizzabili (relativi al costo delle cure e alle giornate di lavoro perdute) e non quantizzabili, relativi al dolore fisico di cure invasive, all’angoscia, alla depressione reattiva, alle preoccupazioni personali e familiari. Alla sofferenza fisica si aggiunge infatti il peso emotivo che ogni donna è costretta a sopportare, poiché questo tipo di malattie può avere un forte impatto sulla vita e sul benessere psicologico sia della donna sia della sua famiglia. Non ultimo, è rilevante anche l’impatto sulla sessualità della donna e della coppia (Graziottin e Serafini, 2009).
Per questo è fondamentale che il pediatra, insieme al ginecologo e al medico di famiglia, abbia un ruolo proattivo nell’incoraggiare la vaccinazione delle adolescenti (Jenson, 2009), in parallelo all’impegno per un’educazione all’autoprotezione, sia sul fronte contraccettivo sia sul fronte delle malattie sessualmente trasmesse.
Nella prima parte della scheda vengono discussi gli aspetti più importanti del vaccino, nella seconda le implicazioni pratiche sia dell’infezione da HPV, sia del vaccino, e il suo ruolo nella prevenzione primaria, rispetto ai programmi di prevenzione secondaria mediante pap-test, colposcopia ed eventuale biopsia mirata.
Quanti tipi di vaccino anti Papillomavirus esistono attualmente?
Uno è bivalente, ossia protegge contro due tipi di HPV (16 e 18) responsabili del 70% dei carcinomi del collo dell’utero.
L’altro è quadrivalente: non solo protegge contro i ceppi 16 e 18, come il precedente, ma è in grado di offrire una protezione aggiuntiva anche contro i tipi di HPV 6 e 11, responsabili del 90% dei condilomi genitali (o verruche veneree) e di una parte (circa il 10%) delle lesioni intraepiteliali di grado lieve (Intraepithelial Cervical Neoplasia, CIN I).
Come funziona il vaccino? Può provocare il rischio di contrarre malattie da HPV?
La ragione sta nella struttura del Papillomavirus, che ha due componenti principali: il capside, o capsula virale, una specie di involucro-carrozzeria che racchiude l’altra parte fondamentale, il DNA virale, che possiamo assimilare invece al motore dell’auto. E’ il DNA che trasmette l’infezione, mentre il capside, che racchiude il DNA virale e lo veicola, può solo stimolare la risposta anticorpale (zur Hausen, 2002, 2009).
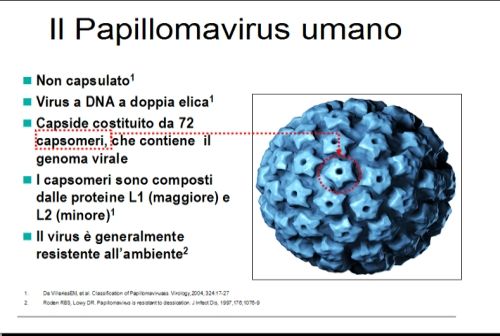
I Papillomavirus sono infatti virus piccoli e semplici, formati da DNA a doppia elica, contenente i diversi geni necessari alla loro replicazione, in circa 8.000 kbasi, e rivestiti da un semplice rivestimento proteico, formato dal ripetersi di due proteine solamente: la L1, più numerosa e più “esterna”, e la L2, meno numerosa e più “interna” (Longworth et Al, 2004; Muñoz et Al, 2006). Tale rivestimento è organizzato in un capside a geometria icosaedrica formato da 72 capsomeri. ognuno a sua volta composto da una “rosetta” di cinque proteine L1, il tutto per una dimensione di circa 55 nanometri. Il gene L1 determina variazioni nella proteina del capside virale, cioè il contenitore del DNA virale, e quindi determina la “diversità esteriore”, la diversa “carrozzeria” dei vari Papillomavirus umani, riconoscibili in base a specificità della proteina L1, che equivale al “numero di targa”. La definizione tassonomica degli HPV in tipi, sottotipi e varianti si basa infatti sulla sequenza del gene che regola la costruzione della proteina L1, che differisce rispettivamente nel 10%, 2-10% e 2% della sequenza stessa.
Ecco la certezza di innocuità: il vaccino contiene come principio attivo solo particelle identiche alla proteina L1 della capsula virale che, come si è detto, possiamo assimilare alla targa dell’automobile. Il bivalente contiene quindi le proteine L1, e quindi le targhe, del ceppo 16 e 18, il quadrivalente le proteine L1, e quindi le targhe specifiche, del ceppo 6, dell’11, del 16 e del 18.
Il vaccino non contiene invece DNA virale: ecco perché non esiste alcuna possibilità di trasmettere il virus (come succede invece per i vaccini con virus attenuati, come l’antipolio o l’antirosolia). La proteina L1 induce una risposta anticorpale, ossia la produzione di un corpo di “riservisti” in grado di entrare immediatamente in azione qualora Papillomavirus targati 6,11,16 e 18 entrino in contatto con il corpo, così da impedirne l’azione infettiva e quindi patogena (Markowitz et Al, 2007).
La struttura del Papillomavirus umano
Come si ottengono le proteine L1 del vaccino?
Queste particelle L1, del tutto innocue, una volta introdotte nell’organismo non fanno altro che innescare la normale risposta anticorpale dell’organismo, eliminando il rischio di provocare alcuna conseguenza dal punto di vista delle patologie proprio perché, come si è detto, NON contengono DNA virale (Schiller et Al, 2008).
Il vaccino inoltre contiene come adiuvante l’AAHS (alluminio idrossifosfatosolfato amorfo), brevettato da Merck, che aumenta l’efficacia nell’induzione della risposta anticorpale perché “presenta” le proteine L1 con una modalità che ne ottimizza la capacità immunogena (zur Hausen, 2009). Questo adiuvante è già da anni utilizzato in numerosi altri vaccini in commercio anche in Italia, con un profilo di efficacia e sicurezza comprovato dalla vasta esperienza di utilizzo (milioni di soggetti vaccinati).
Come va somministrato il vaccino?
Ove sia necessaria una programmazione vaccinale alternativa, la seconda dose deve essere somministrata almeno 1 mese dopo la prima dose, e la terza dose almeno 3 mesi dopo la seconda dose. Tutte e tre le dosi devono essere somministrate entro il periodo di 1 anno.
Non è stata stabilita la necessità di una dose di richiamo.
Il vaccino anti HPV non è raccomandato per l’impiego nei bambini di età inferiore ai 9 anni, poiché i dati di immunogenicità, sicurezza ed efficacia in questa fascia di età non sono sufficienti. Non ci sono al momento dati disponibili sulla immunogenicità in bambine con pubertà precoce, di età inferiore ai nove anni.
Il vaccino deve essere somministrato per iniezione intramuscolare. Il sito preferito è la regione deltoidea del braccio o l’area anterolaterale superiore della coscia.
Il vaccino anti HPV NON deve essere iniettato per via intravascolare. Le somministrazioni per via sottocutanea e intradermica non sono state studiate e, pertanto, non sono raccomandate.
Quali sono le principali controindicazioni?
La somministrazione del vaccino deve essere rimandata nei soggetti affetti da malattie febbrili gravi in fase acuta. Tuttavia la presenza di un’infezione minore, come una lieve infezione del tratto respiratorio superiore o un lieve rialzo febbrile, non rappresenta una controindicazione all’immunizzazione.
La somministrazione del vaccino va considerata con cautela anche nei soggetti affetti da trombocitopenia o da ogni altro disturbo della coagulazione, poiché in questi soggetti può verificarsi un sanguinamento a seguito della somministrazione per via intramuscolare.
Attenzione: come per tutti i vaccini iniettabili, un adeguato trattamento medico deve essere sempre prontamente disponibile in caso di una rara reazione anafilattica a seguito della somministrazione del vaccino (Zimmerman 2007).
Quali sono i principali effetti collaterali?
- molto comuni (maggiori o uguali a 1/10 );
- comuni (maggiori o uguali a 1/100, minori di 1/10);
- non comuni (maggiori o uguali a 1/1.000, minori di 1/100);
- rari (maggiori o uguali a 1/10.000, minori di 1/1.000);
- molto rari (minori di 1/10.000).
Gli effetti collaterali principali indotti dal vaccino sono i seguenti (Markowitz et Al, 2007; Zimmerman, 2007; Rogers, 2008):
Molto comuni (1 su 10):
- generali: piressia (rialzo febbrile);
- al sito di iniezione: eritema, dolore e gonfiore;
Comuni (1 su 100):
- al sito di iniezione: sanguinamento, prurito;
Rari (1 su 10.000):
- orticaria;
Molto rari (minori di 1 su 10.000):
- broncospasmo.
In caso di concepimenti accidentali in corso di vaccinazione, la percentuale di aborti spontanei è stata sovrapponibile al gruppo trattato con placebo. Non sono invece stati evidenziati effetti collaterali sull’allattamento se la vaccinazione è stata effettuata in questo periodo della vita.
Il vaccino è anche terapeutico?
Sono però allo studio sperimentale vaccini terapeutici in grado di ridurre l’azione oncogena dopo che il virus è già entrato a contatto con l’organismo. Ma ci vorranno ancora diversi anni prima che dalla sperimentazione si passi all’utilizzo clinico.
La protezione tramite vaccino è verso tutti i tipi di HPV che causano le patologie?
Il quadrivalente, proprio grazie alla sua formulazione, previene anche i tipi 6 e 11. I quattro tipi di virus presi nel loro insieme sono i responsabili della maggior parte delle patologie infettive da Papillomavirus a carico dell’apparato genitale femminile.
E' vero che il vaccino anti HPV è in grado di offrire una "protezione crociata"?
Nel settembre 2008 l’Agenzia Europea del Farmaco (European Medicines Agency, EMEA) ha autorizzato l’aggiornamento delle indicazioni del vaccino quadrivalente che ad oggi è l’unico ad avere un’efficacia dimostrata di “protezione crociata” anche contro altri tipi di HPV non direttamente coperti dal vaccino.
Il meccanismo della protezione crociata è dovuto alla stretta somiglianza tra le proteine L1 dei ceppi 16 e 18 e quelle di altri ceppi oncogeni, quali il 31, il 33, il 35, il 39, il 45, il 51, il 52, il 56, il 58 e il 59. Potremmo dire che poiché questi ceppi hanno numeri di targa quasi uguali, possono indurre una produzione anticorpale in grado di riconoscere con buona efficienza anche questi ceppi aggiuntivi.
L’efficacia della protezione crociata è stata dimostrata particolarmente nei confronti del tipo 31 (Brown et Al, 2009) che rappresenta, in Europa, il secondo tipo di virus più comune (dopo il tipo HPV 16) nel causare le lesioni precancerose cervicali. Come frequenza, risulta anche il quarto tipo di HPV (dopo l’HPV 16, 18 e 33) nel causare cancro del collo dell’utero, in Europa. In particolare, il 31 provoca circa il 25 per cento delle rimanenti lesioni precancerose al collo dell’utero e il 15 per cento dei rimanenti casi di cancro alla cervice uterina, non correlati ai tipi 16 e 18.
Il vaccino quadrivalente ha determinato una riduzione del 40,3% delle infezioni causate dai ceppi 31 e 45; e una riduzione del 43,6% delle lesioni CIN 1-CIN 3 e dell’adenocarcinoma in situ causate da questi ceppi (Brown et Al, 2009).
L’efficacia globale della cross-protezione nei confronti di lesioni intracervicali (CIN2-3 e adenocarcinoma in situ), indotte da 10 tipi di HPV non vaccinali ad alta oncogenicità è risultata del 32,5% (Brown et Al, 2009).
Grazie alla protezione crociata, si calcola che vaccinandosi si ottenga una protezione superiore all’85 per cento di tutti i casi di cancro del collo dell’utero.
Quanto dura la protezione tramite vaccino? Esistono dei dati d'efficacia a lungo termine e come si valutano?
a) la percentuale di “responders”, ossia di persone il cui organismo risponde alla vaccinazione con un’adeguata produzione anticorpale. Studi di fase III per il vaccino quadrivalente hanno dato un risultato pari al 99,5 per cento, ossia la vasta maggioranza delle donne vaccinate ha risposto efficacemente al vaccino. I soggetti con una risposta immunitaria ridotta, dovuta all’impiego di una forte terapia immunosoppressiva, a un difetto genetico, a infezione da virus dell’immunodeficienza umana (HIV) o ad altre cause, possono non rispondere al vaccino, contribuendo allo 0,5% di non-responders;
b) le analisi matematiche che analizzano i modelli di eventuale decadimento del titolo anticorpale nel tempo. Diversi studi scientifici suggeriscono che l’efficacia del vaccino contro i quattro tipi di HPV (6, 11, 16 e 18) sia a lungo termine (zur Hausen, 2002, 2009);
c) la memoria immunitaria. Nelle donne trattate con vaccino quadrivalente cinque anni prima, è stata osservata una memoria immunitaria di alto livello nel momento in cui il loro sistema immunitario è stato nuovamente esposto ai tipi di virus contenuti nel vaccino. La memoria immunitaria è segno di protezione a lungo termine.
Sarà necessario fare un richiamo?
Per valutare l'efficacia di questa vaccinazione non sarebbe necessario fare il dosaggio degli anticorpi come si fa per altre vaccinazioni?
L’Organizzazione Mondiale della Sanità (OMS) e la Food and Drug Administration (FDA, USA) hanno dichiarato che per valutare l’efficacia della vaccinazione HPV è necessario basarsi su end-point rigorosi che evidenzino la reale capacità di prevenire le patologie oncologiche legate a questo virus (Markowitz et al, 2007). End point clinici necessari anche per valutare il rapporto costi-benefici della vaccinazione stessa (Marra et Al, 2009).
Per i vaccini anti HPV, infatti, non è stato identificato nessun livello minimo di anticorpi proprio perché non è questo l’obiettivo. I livelli anticorpali, infatti, non forniscono informazioni sostanziali su come i vaccini siano in grado di prevenire il cancro del collo dell’utero, o anche se sono in grado di farlo.
Attualmente negli Stati Uniti è autorizzato solo il vaccino quadrivalente, che ha dimostrato un’efficacia preventiva significativa nei confronti dei singoli HPV vaccinali considerati. La percentuale è del 100% nel breve termine. L’efficacia preventiva si mantiene su percentuali del 98-100 per cento nel più lungo follow-up ad oggi esistente, ottenuto su dati di fase III per il vaccino contro il cancro del collo dell’utero, dopo 7 anni dalla prima dose.
È vero che si sono verificati casi gravi di reazioni avverse legate a questa vaccinazione?
Questi dati di sorveglianza post-marketing, i più sicuri e definitivi nel chiarire il reale impatto di un farmaco sulla popolazione trattata, sono del tutto rassicuranti. Come si diceva, non è stato evidenziato alcun effetto avverso grave riconducibile al vaccino.
I dati di sorveglianza post-marketing sono essenziali dal punto di vista sanitario, per tutti i farmaci e presidi sanitari immessi sul mercato. Nello specifico, per tutte le vaccinazioni esiste un sistema di controllo molto efficiente che si occupa di analizzare e catalogare qualsiasi tipo di reazione post vaccino si verifichi in una persona: dal più comune dolore localizzato sulla zona dell’iniezione, al rialzo della temperatura fino alle gravi conseguenze. In generale va però sottolineato che la segnalazione spontanea di un evento post vaccinazione non vuol dire che esista una relazione causale tra tale evento e l’atto della vaccinazione, ma solo che questo evento si è manifestato successivamente alla somministrazione di un vaccino (Jenson, 2009).
L’analisi dell’eventuale effetto avverso e della sua base fisiopatologica consente poi di verificare se sia o meno causalmente correlato al farmaco o al vaccino somministrato.
Nello specifico, tutti i dati di sorveglianza post-marketing attualmente disponibili e relativi al vaccino tetravalente non hanno evidenziato potenziali rischi per la salute (Markowitz et Al, 2007; Jenson 2009). L’analisi delle reazioni più gravi alla vaccinazione anti HPV, amplificate da stampa e Internet, a livello scientifico non hanno rivelato alcun legame causale con il vaccino stesso. Tanto che nessuna autorità regolatoria europea e americana ha ipotizzato di modificare le indicazioni del prodotto o di fare segnalazioni per quanto riguarda la sua sicurezza.
Approfondimenti specialistici
Brown D.R. Kjaer S.K. Sigurdsson K. Iversen O.E. Hernandez-Avila M. Wheeler C.M. et Al.
The Impact of Quadrivalent Human Papillomavirus (HPV Types 6, 11, 16, and 18) L1 Virus-Like Particle Vaccine on Infection and Disease Due to Oncogenic Nonvaccine HPV Types in Generally HPV-Naive Women Aged 16-26 Years
J Infect Dis. 2009 Apr 1; 199 (7): 926-35
Graziottin A. Serafini A.
HPV infection in women: psychosexual impact of genital warts and intraepithelial lesions
The Journal of Sexual Medicine, 2009 Mar; 6 (3): 633-645
Link a PubMed
Jenson H.B.
Human papillomavirus vaccine: a paradigm shift for pediatricians
Curr Opin Pediatr. 2009 Feb; 21 (1): 112-21
Longworth MS, Laimins LA.
Pathogenesis of Human Papillomaviruses in Differentiating Epithelia
Microbiology and Molecular Biology Reviews, 2004, 362-372
Markowitz L.E. Dunne E.F. Saraiya M. Lawson H.W. Chesson H. Unger E.R.; Centers for Disease Control and Prevention (CDC); Advisory Committee on Immunization
Quadrivalent Human Papillomavirus Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP)
MMWR Recomm Rep. 2007 Mar 23; 56 (RR-2): 1-24
Marra F. Cloutier K. Oteng B. Marra C. Ogilvie G.
Effectiveness and cost effectiveness of human papillomavirus vaccine: a systematic review
Pharmacoeconomics. 2009; 27 (2): 127-47
Muñoz N. Castellsaguè X. Gonzàles A.B. Gissman L.
HPV in the etiology of human cancer
Vaccine 2006; 24 (suppl. 3): S3/1-S3/10
Rogers L.J. Eva L.J. Luesley D.M.
Vaccines against cervical cancer
Curr Opin Oncol. 2008 Sep; 20 (5): 570-4. Review
Schiller J.T. Castellsagué X. Villa L.L. Hildesheim A.
An update of prophylactic human papillomavirus L1 virus-like particle vaccine clinical trial results
Vaccine. 2008 Aug 19; 26 Suppl 10: K53-61. Review
Smith J. Lindsay L. Hoots B. Keys J. Franceschi S. Winer R. Clifford G.M.
Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions: A meta-analysis update
Int. J. Cancer, 2007: 121, 621-632
Zimmerman R.K.
HPV vaccine and its recommendations
J Fam Pract. 2007 Feb; 56 (2 Suppl Vaccines): S1-5, C1. Review
zur Hausen H.
Papillomavirus and cancer: from basic studies to clinical application
Nat Rev Cancer 2002, 342-50
zur Hausen H.
Papillomaviruses in the causation of human cancers - a brief historical account
Virology. 2009 Feb 20; 384 (2): 260-5
- Condilomatosi genitale: a cosa è dovuta e come affrontarla
- Vaccini per il Papillomavirus: a chi e quando servono
- Le vostre domande sul vaccino contro il Papillomavirus
- Il vaccino contro l'HPV: è efficace anche a 35 anni
- Papillomavirus: il vaccino è sicuro
- Papillomavirus: approfondimenti su contagio, gravidanza e vaccinazione
- Papillomavirus: il vaccino può ridurre le recidive











